 Introdução:
Introdução:
Choque cardiogênico (CS), tal como definido pela Sociedade de Cardiologia (ESC) e o American Heart Association (AHA), é um estado de hipoperfusão crítica de órgãos devido a disfunção cardíaca primária. O diagnóstico inclui alguns achados como hipotensão (pressão arterial sistólica <90 mmHg) ou necessidade de vasopressores para manter pressão arterial sistólica ≥ 90 mmHg; alguns sinais de comprometimento perfusão de órgãos, por exemplo, comprometimento do sistema nervoso central incluindo confusão ou falta de atenção, ou mesmo perda de consciência e oligúria, por comprometimento renal; pele fria e úmida nas extremidades e aumento do lactato arterial> 2 mmol / L; tudo isso num estado de normovolemia ou hipervolemia. Do ponto de vista hemodinâmico, também são incluídos parâmetros como: o índice cardíaco (IC) reduzido, ou seja, IC <1,8 L/min/m2 (sem medidas de suporte) ou <2,2 L /min /m2 (com medidas de suporte cardíaco), ou ainda, a elevação das pressões de enchimento do ventriculo esquerdo, evidenciada através da medida da pressão capilar pulmonar > 15 mmHg.
Um detalhe importante é que também há descrição de alguns casos como um “estado de pré-choque” que incluem pacientes com risco de choque cardiogênico. Além disso, os pacientes podem ter choque cardiogênico sem alterações na pressão arterial (PA), mas já com sinais de hipoperfusão.
A forma mais grave de choque cardiogênico (choque refratário) é definida como um choque persistente apesar da administração de volume, inotrópicos e drogas vasopresoras. Choque cardiogênico após infarto agudo do miocárdio (IAM) tem uma incidência de 5-10% e é a principal causa de mortalidade em pacientes com IAM.
Metade dos casos de choque cardiogênico está presente na admissão hospitalar e a outra metade se desenvolve durante o período de internação. Entre os pacientes com IAM, o registro do estudo SHOCK relatou que a insuficiência ventricular esquerda (78,5%) foi a etiologia mais comum de choque cardiogênico, seguida de insuficiência mitral grave (6,9%), ruptura do septo ventricular (3,9%), insuficiência ventrícular direita (2,8%) e tamponamento cardíaco (1,4%). A mortalidade a curto prazo no choque cardiogênico como complicação de IAM é 40-60%, podendo chegar a 80% se a etiologia do choque for ruptura do septo interventricular. A mortalidade do choque cardiogênico é vista principalmente durante a internação na unidade de terapia intensiva (UTI). No entanto, após a alta hospitalar, a mortalidade e insuficiência cardíaca sintomática em pacientes com choque cardiogênico ainda são maiores do que após IAM sem choque. Pacientes nas categorias de baixo, intermediário e alto risco têm mortalidade intra-hospitalar de 20 a 30%, 40 a 60% e 70 a 90%, respectivamente.
Abordagem:
O reconhecimento clínico do choque cardiogênico como complicação do IAM deve ser rápido e a abordagem inclui história, exame físico, investigações laboratoriais, eletrocardiograma (ECG) e ecocardiograma. Após o reconhecimento do choque, as medidas não devem ser retardadas.
A pressão arterial deve ser monitorada usando-se continuamente linha arterial invasiva e a monitorização hemodinâmica invasiva pode ser considerada para os casos refratários graves e / ou quando complicações mecânicas surgirem. A pressão arterial média deve estar na faixa de 60 a 65 mmHg, apesar desta meta de pressão arterial não sido validada em ensaios clínicos randomizados.
A inserção do cateter venoso central permite analisar ScvO2 para a avaliação do taxa global demanda e oferta de oxigênio, portanto, serve como guia de resposta à terapia instituída. A linha central também é a via preferencial para a administração de inotrópicos e/ou vasopressores. Idealmente, os esforços devem ser mantidos para manter a PVC abaixo de 12mmHg.
A ecocardiografia é recomendada repetidamente durante a permanência na UTI para avaliação da função ventricular esquerda e direita, disfunção valvular e excluir ou diagnosticar complicações mecânicas. A ecocardiografia também está surgindo como uma ferramenta de monitorização hemodinâmica em UTIs para estimar débito cardíaco, pressões de enchimento, prever a capacidade de resposta do volume e determinar a resposta a intervenções de cuidados intensivos. É obrigatória sua realização para o uso de suporte circulatório mecânico, para avaliar contraindicações, informar o tipo e nível de suporte necessário, orientar e monitorar a instituição de apoio, avaliar complicações e prever potencial para o desmame. A ecocardiografia pode nos fornecer informações adicionais com a ultrassonografia de tórax, tais como: congestão pulmonar e derrame pelural.
Atualmente as recomendações da Sociedade Europeia de Terapia Intensiva ainda considera o cateter de artéria pulmonar como uma ferramenta útil em alguns pacientes com choque cardiogênico grave, especialmente no caso de disfunção do ventrículo direito ou o choque cardiogênico não responsivos às medidas iniciais.
Os testes laboratoriais no paciente com choque cardiogênico devem incluir troponina, peptídeos natriuréticos, dosagem de ST2 (até esta data do artigo ainda não está disponível no Brasil) principalmente para avaliar prognóstico, lactato nos primeiros dias, análise de função renal, hepática, testes básicos de coagulação e hemograma. Pode ser realizado até duas vezes ao dia ou até a estabilização dos parâmetros hemodinâmicos.
As alterações hemodinâmicas no choque cardiogênico associado ao IAM e as alterações de perfusão sistêmica podem requerer uso de drogas inotrópicas e vasopressores. Quando a pressão arterial precisa ser restaurada rapidamente, norepinefrina pode ser um agente razoável de primeira linha. Vários estudos mostraram que a norepinefrina é mais segura que a dopamina, vasopressina ou epinefrina, com menor risco de arritmias atriais. A adição de um agente inotrópico pode ajudar a melhorar o volume sistólico após estabilização hemodinâmica com um vasopressor. Na vigência de baixo débito cardíaco e pressão de perfusão preservada, a dobutamina é a primeira terapia de escolha (dose inicial 2,5 μg / kg / min). Os seguintes agentes geralmente não são considerados primeira linha: a dopamina, pois mostrou estar associada com aumento da mortalidade em 28 dias, bem como maior número de arritmias em comparação com a norepinefrina, evidenciado no trabalho publicado por De Backer que avaliou o uso da dopamina versus a noradrenalina; a epinefrina no choque cardiogênico é deletéria, apoiado por uma análise retrospectiva do estudo OPTIMA CC; a vasopressina, no choque cardiogênico, também não é preferida porque esta droga não alterou o índice cardíaco, enquanto a noradrenalina aumentou.
Quanto ao Suporte Circulatório Mecânico no choque cardiogênico :
– Recomendações sobre o uso de balão intra-aórtico:
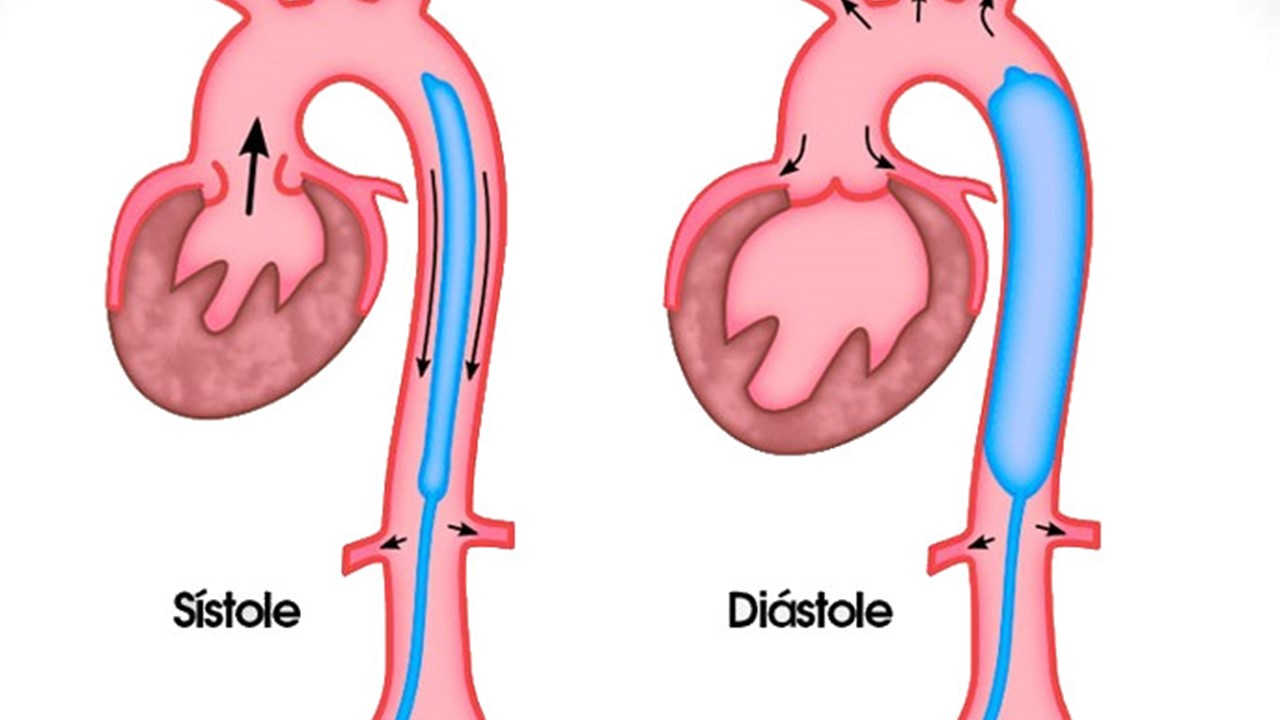 O IABP-SHOCK II randomizou 600 pacientes com choque cardiogênico como complicação de IAM submetidos a revascularização precoce para estratégia com balão intra-aórtico e tratamento convencional, não sendo encontrada diferença no endpoint primário do estudo de mortalidade em 30 dias entre dois grupos de tratamento. Estes resultados levaram a um diminuição do uso do balão intra-aórtico nas diretrizes da Sociedade Europeia de Cardiologia (ESC) com um recomendação atual da classe III B para o uso rotineiro no choque cardiogênico. As diretrizes do ESC STEMI 2017 agora recomenda o uso de balão intra-aórtico apenas em pacientes com complicações mecânicas (classe IIa, nível C) .
O IABP-SHOCK II randomizou 600 pacientes com choque cardiogênico como complicação de IAM submetidos a revascularização precoce para estratégia com balão intra-aórtico e tratamento convencional, não sendo encontrada diferença no endpoint primário do estudo de mortalidade em 30 dias entre dois grupos de tratamento. Estes resultados levaram a um diminuição do uso do balão intra-aórtico nas diretrizes da Sociedade Europeia de Cardiologia (ESC) com um recomendação atual da classe III B para o uso rotineiro no choque cardiogênico. As diretrizes do ESC STEMI 2017 agora recomenda o uso de balão intra-aórtico apenas em pacientes com complicações mecânicas (classe IIa, nível C) .
– Outros dispositivos de assistência circulatória mecânica percutânea:
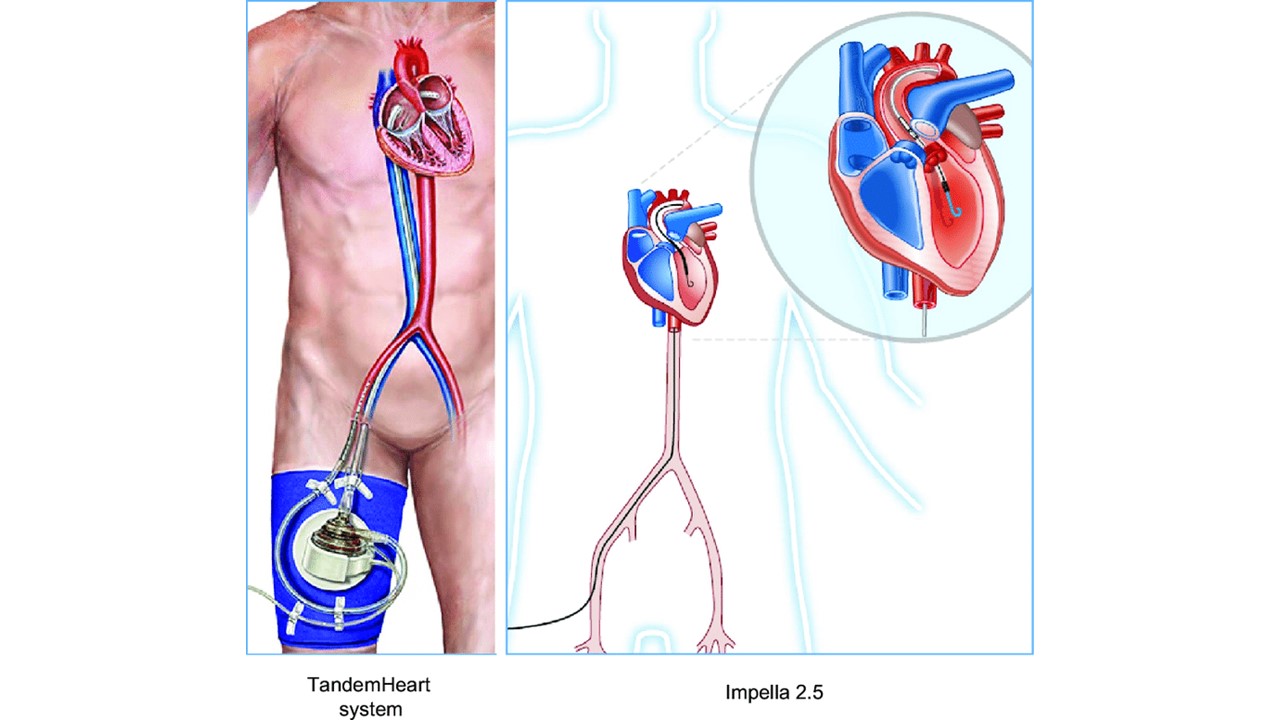
Os dispositivos atuais incluem o TandemHeart™ (Cardiac Assist, Inc, Pittsburgh, EUA) que remove sangue arterializado do átrio esquerdo (através de uma punção transseptal por um cateter inserido pela veia femoral) fazendo retornar para o sistema arterial, retorna ao sistema arterial por outra cânula inserida na artéria femoral, passando por uma bomba capaz de fornencer vazões de até 4,0 L/min por uma cânula introduzida pela artéria femoral. Outro dispositivo percutâneo é o Impella 2,5 CP, ou 5.0 (Abiomed Europe, Aachen, Alemanha) em que um cateter é introduzido através de punção da artéria femural até atravessar a valva aórtica e se posicionar dentro do ventrículo esquerdo. O dispositivo é capaz de retirar o sangue do ventrículo através de sucção e liberar na aorta por uma segunda via que fica acima da valva aórtica. Isso melhora a perfusão coronariana e diminui a necessidade de de drogas inotrópicas.
– ECMO VA ( veno-arterial):
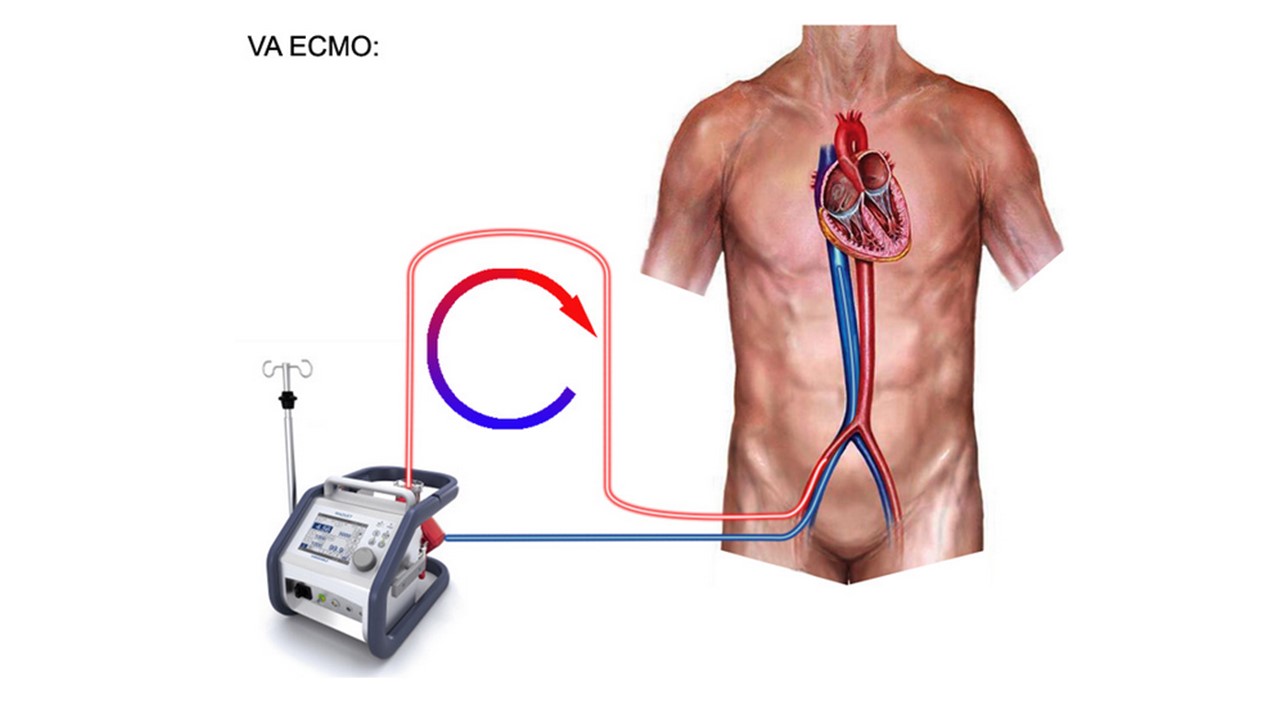 Suporte circulatório extracorpóreo com oxigenação por membrana extracorpórea venoarterial. Fornece suporte respiratório e cardíaco pela extração de sangue de uma cânula de entrada venosa e retorna ao sistema arterial através de uma cânula de saída após descarboxilação e oxigenação. Pode ser a opção preferida em casos de choque cardiogênico por causa de algumas vantagens, como a possibilidade de aplicação rápida, a utilização em caso de arritmia maligna por falta de alteração da condição de fluxo e melhoria rápida na oxigenação. Por outro lado, o VA-ECMO carrega um risco relevante de eventos tromboembólicos e isquemia, além de poder aumentar a pós-carga do ventrículo esquerdo, causando prejuízo à recuperação da função cardíaca e agravando a hidrostase e o edema pulmonar. Além disso, requer um especialista na equipe para inserir e executar ECMO como perfusionistas ou especialistas em ECMO. Em uma recente meta-análise baseada em dados do registro observacional, a VA-ECMO foi associada com sobrevida em 30 dias maior em 33% em comparação com o balão intra-aórtico, mas sem diferença quando comparado com TandemHeart / Impella.
Suporte circulatório extracorpóreo com oxigenação por membrana extracorpórea venoarterial. Fornece suporte respiratório e cardíaco pela extração de sangue de uma cânula de entrada venosa e retorna ao sistema arterial através de uma cânula de saída após descarboxilação e oxigenação. Pode ser a opção preferida em casos de choque cardiogênico por causa de algumas vantagens, como a possibilidade de aplicação rápida, a utilização em caso de arritmia maligna por falta de alteração da condição de fluxo e melhoria rápida na oxigenação. Por outro lado, o VA-ECMO carrega um risco relevante de eventos tromboembólicos e isquemia, além de poder aumentar a pós-carga do ventrículo esquerdo, causando prejuízo à recuperação da função cardíaca e agravando a hidrostase e o edema pulmonar. Além disso, requer um especialista na equipe para inserir e executar ECMO como perfusionistas ou especialistas em ECMO. Em uma recente meta-análise baseada em dados do registro observacional, a VA-ECMO foi associada com sobrevida em 30 dias maior em 33% em comparação com o balão intra-aórtico, mas sem diferença quando comparado com TandemHeart / Impella.
Atualmente, o uso de suporte mecânico percutâneo deve ser restrito ao choque cardiogênico refratário (classe de recomendação II b nível de evidência C) e contará com experiência individual em centros dedicados para pacientes selecionados. Ensaios randomizados adicionais são necessários para uma avaliação mais completa do papel das diferentes estratégias de suporte circulatório no choque cardiogênico.

Clique AQUI para fazer download do artigo original publicado na Intensive Care Med






